En lisant cette page : http://www.minresi.net/minresi/index2.php?cat=info4 j’ai aperçu des données vérifiables.
Je cite le passage concerné :
- «Car cette petite molécule (le dihydrogène) est fortement énergétique : 1 kg d’H libère 120 mégajoules, alors qu’1 kg d’essence en libère trois fois moins. Mais – il y a un mais – il est beaucoup moins dense, il faut le comprimer, pour libérer ces 120 mégajoules, il faut 13 litres d’H comprimés à 700 bars.»
Le web est une ressource intéressante qui peut servir à faire des exercices de maths et de physique. Ici, il s’agit de thermodynamique. Les lycéens en Terminale S trouveront cela intéressant.
- Est-ce que 1 kg d’hydrogène libère 120 MJ ?
1). Vérification via wolframalpha :
En écrivant dans la barre de recherche du site http://www.wolframalpha.com avec cette instruction suivante : H2 + O2 = water, le résultat de l’équation bilan a fourni les enthalpies de la réaction chimique de combustion du dihydrogène avec le dioxygène.
Ainsi, la réaction est exothermique et libère une chaleur de 285,8 kJ par mole de dihydrogène, ce qui équivaut à 142,9 kJ par gramme de H2, soit donc 142,9 MJ par kg de H2. Ce qui est 19,1% de plus que les 120 MJ prétendus par le site web étudié.
Toujours via wolframalpha, le résultat de la réaction de l’octane avec le dioxygène est le suivant : libération de 5051 kJ par mole d’octane, ce qui équivaut à 44,31 MJ par kg d’octane. Le ratio entre le pouvoir calorifique (PCI) de l’hydrogène par rapport à celui de l’octane est de 3,225. Donc en gros, il est correct de dire que l’octane est massiquement trois fois moins calorifique que l’hydrogène.
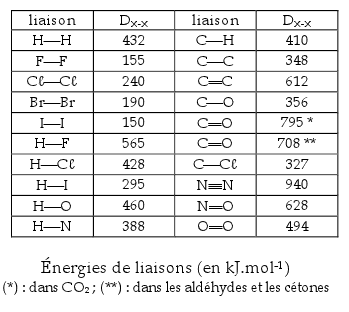
2). Vérification d’après un tableau des énergies de liaisons covalentes :
Ensuite, une seconde vérification se base sur le tableau ci-dessous :
En thermodynamique chimique, c’est simple : chacune des molécules possède des liaisons chimiques covalentes, et l’agencement de ces liaisons se modifie complètement au cours d’une réaction chimique à l’issue de laquelle il existe une différence entre la somme des énergies de liaisons des réactifs et la somme des énergies de liaisons des produits.
D’après la réaction 2 H2 + O2 -> 2 H2O on remarque que dans 2 moles d’hydrogène il y a 2 liaisons H-H, dans 1 mole d’oxygène il y a 1 liaison O=O, dans 2 moles d’eau il y a 4 liaisons O-H. Alors, dans le mélange hydrogène + oxygène (3 moles), il y a 1358 kJ d’énergies de liaison, puis dans les molécules d’eau produites (2 moles de vapeur), il y a 1840 kJ d’énergies de liaison. Ainsi, la réaction est exothermique, et elle produit un excès de chaleur de 482 kJ pour 2 moles d’hydrogène, soient 241 kJ par mole de H2.
Résultat : cela équivaut à 120,5 kJ/g, donc 120,5 MJ/kg d’hydrogène.
Ce résultat est sensiblement très proche de ce qu’affirme le site web étudié.
Les résultats donnés par wolframalpha peuvent donc comporter de regrettables erreurs. Ce n’est pas la première fois que je constate cela. Il convient donc de toujours recouper les infos par des sources d’infos indépendantes.
3). Vérification au moyen du site AZPROCEDE :
Je termine l’analyse par une troisième vérification, au moyen de ce site : http://www.azprocede.fr/Cours_GC/combustion_equation.html
La lecture nous renseigne que la réaction de combustion de l’hydrogène avec l’oxygène (avec enthalpie de formation à 25°C) libère une énergie calorifique de 241,6 kJ par mole de dihydrogène. Cela équivaut à 120,8 MJ par kg de dihydrogène.
Là aussi, comme dans la précédent vérification (la deuxième), je trouve un résultat sensiblement proche de la valeur donnée par le site web étudié.
Quand je m’étais basé sur wolfframalpha, je commençais à conclure que Minresi avait fourni une valeur fausse. Mais deux autres sources indépendantes ont prouvé que Minresi ne s’était pas trompé. En revanche, les données produites par wolframalpha ne sont pas toujours fiables, je retiens cette leçon. Si je ne m’étais basé que sur wolframalpha, j’aurais pris le risque de conclure par une connerie…
J’ai néanmoins une conclusion qui montre une légère incohérence, sans gravité. En effet, de l’hydrogène comprimé à 700 bars et dont le volume (comprimé) est de 13 litres, cela correspond à 812,5 grammes de dihydrogène dans les conditions standards de température, et non 1 kg. On a 1 kg d’hydrogène si on a 16 L de gaz comprimé à 700 bars (à 25°C).
© 2013 John Philip C. Manson
Vous devez être connecté pour poster un commentaire.